
外泌体(Exosome)是由细胞内多泡体与细胞膜融合后,释放到细胞外的一种直径约30~150nm或者200nm的膜性囊泡,在细胞、血液、乳液、体液、动植物及临床样本中大量存在;其结构由磷脂双分子及其携带的膜性分子组成,主要成分为蛋白质、酶、mRNA、miRNA、DNA片段和脂质等;外泌体被认为具有细胞间信使的功能,在特定细胞之间传递它们的效应物或信号分子。
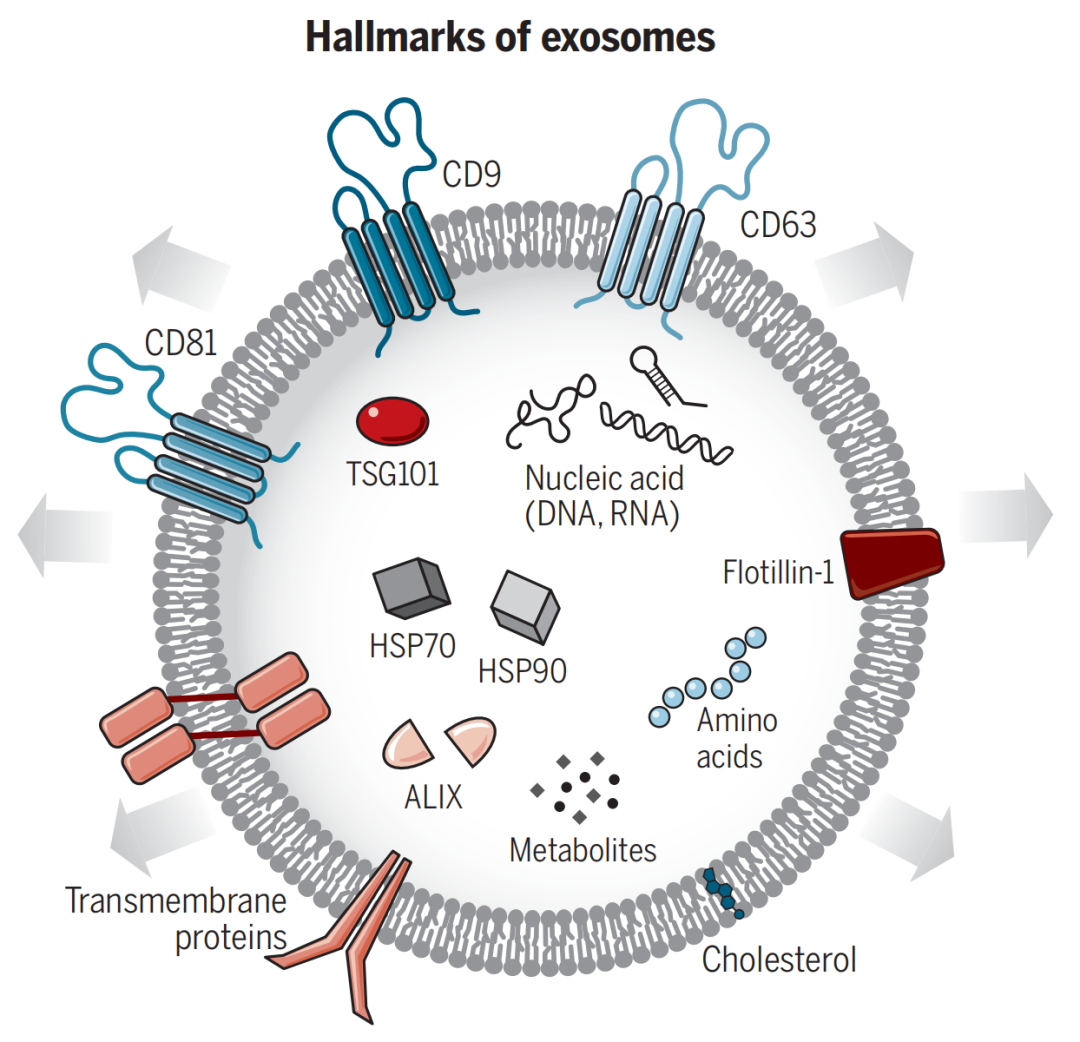
Science. 2020 Feb 7;367(6478):eaau6977
外泌体荧光标记是一种关键技术,用于在体外或体内追踪外泌体的去向、摄取、分布和功能。常用的外泌体荧光标记染料主要分为两大类,一类是结合到细胞膜脂质区域上的脂溶性染料,例如PKH26,PKH67;另一类是能够完全嵌入目标膜的脂质双层并跨膜的水溶性共轭寡电解质(COEs),例如Aco-490,Aco-600。脂溶性染料的缺点是游离染料去除不彻底会增加背景噪音,而水溶性染料具有极高的水溶性,染料溶解在水性缓冲液时,既不会形成胶束,也不会产生纳米颗粒,这一特性使其在纳米流式分析以及细胞摄取实验中,能够有效规避假阳性结果的出现,确保实验数据的准确性与可靠性。
Journal of Nanobiotechnology. 2025 Mar 12;23(1):204
Journal of Environmental Management. 2024 Nov:370:123053
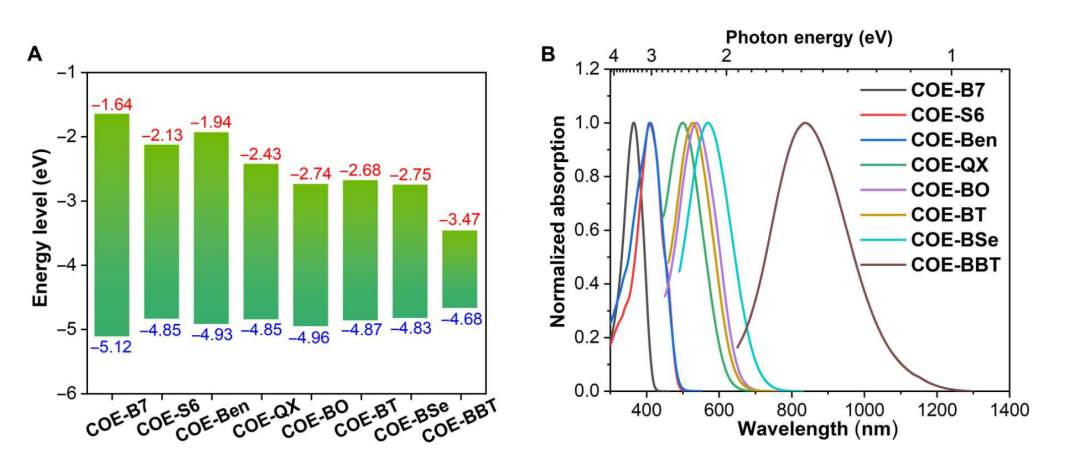
在“Water-soluble extracellular vesicle probes based on conjugated oligoelectrolytes”这篇文章中[1],作者开发了一系列具有从紫外线(UV)到近红外线(IR)波长的可调谐光学发射的跨膜共轭寡电解质(COEs),解决了通过流式细胞仪检测纳米级细胞外囊泡(EVs)时出现假阳性的问题。COEs具有两亲性分子结构,其特征是线性共轭框架和两端带阳离子基团。这种设计赋予了优异的水溶性,并防止了浓度高达50μM的纳米聚集体的形成,未结合的染料很容易通过超滤去除。这些特性使得在流式细胞术中能够直接、精确地检测带有COE标记的小EVs,同时最大程度地减少了背景干扰。此外,COEs能够用于哺乳动物细胞中小EVs摄取的时间推移追踪,以及内源性标记小EVs的方法,显示出良好的生物相容性。这项研究不仅推动了EVs标记技术的发展,为研究纳米级大小的EVs提供了有效的工具,也为基于EVs的诊断和治疗应用提供了新的可能性。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同类型的水溶性染料COE-BT标记EVs,与A549细胞共孵育后用激光共聚焦显微镜观察。
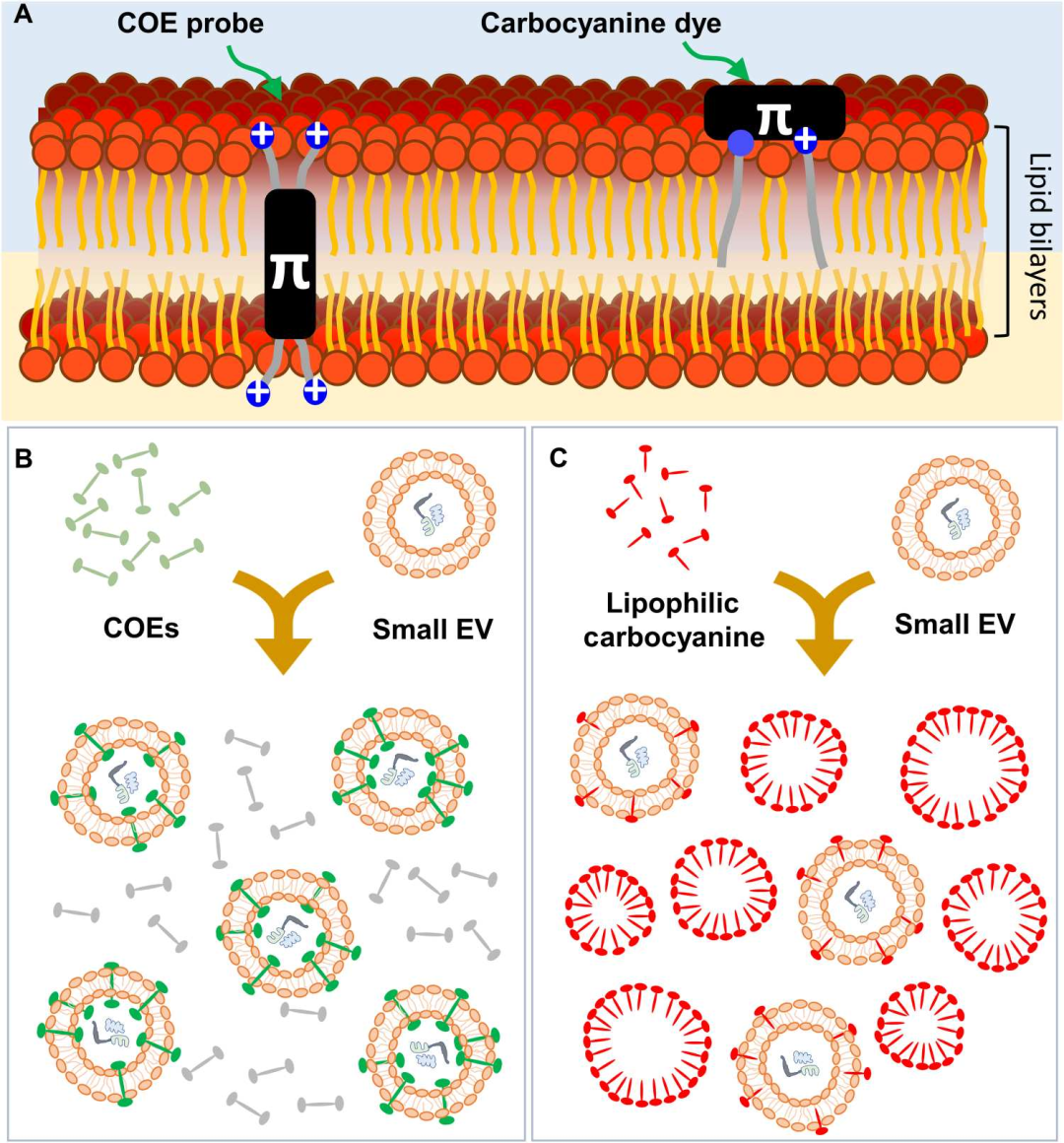
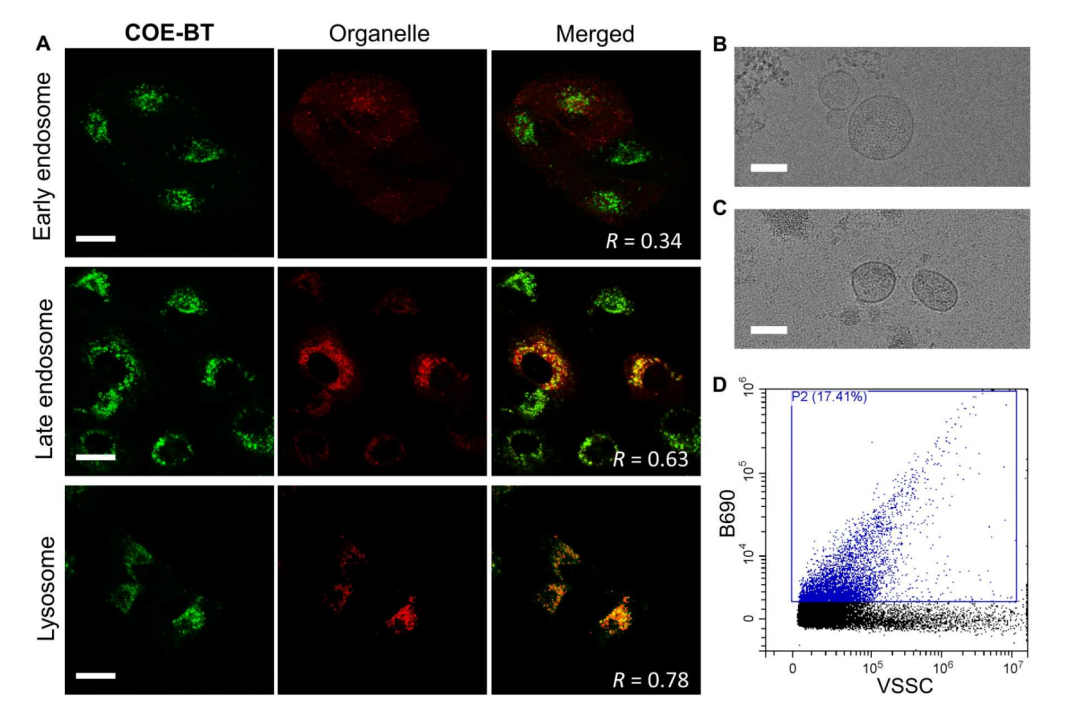
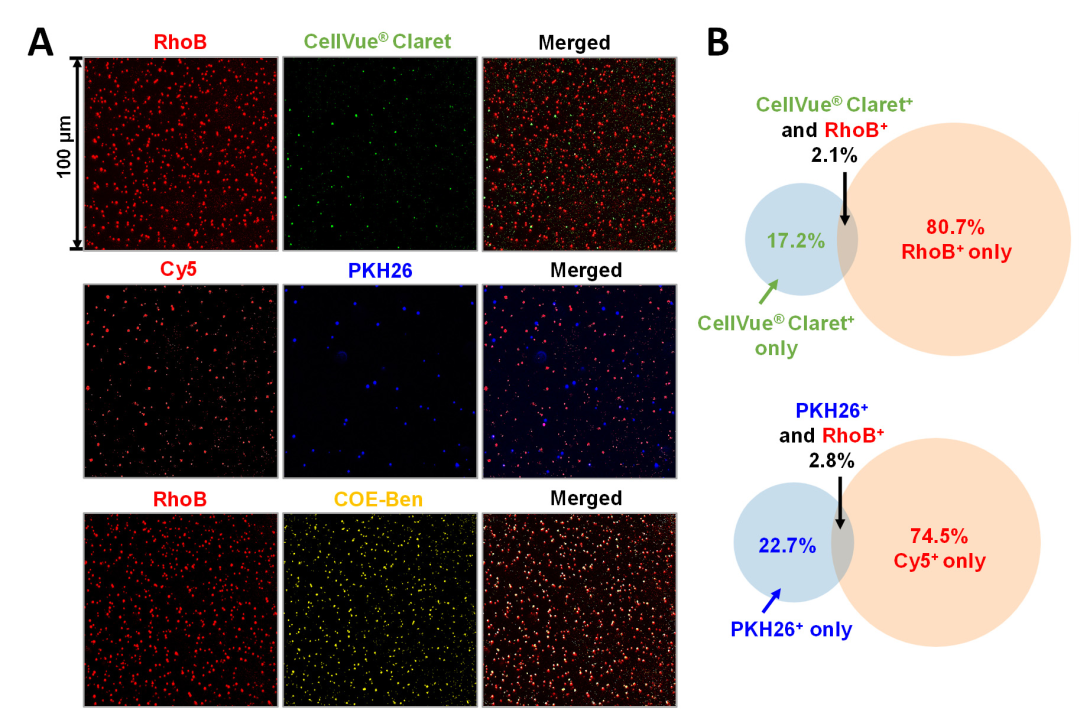
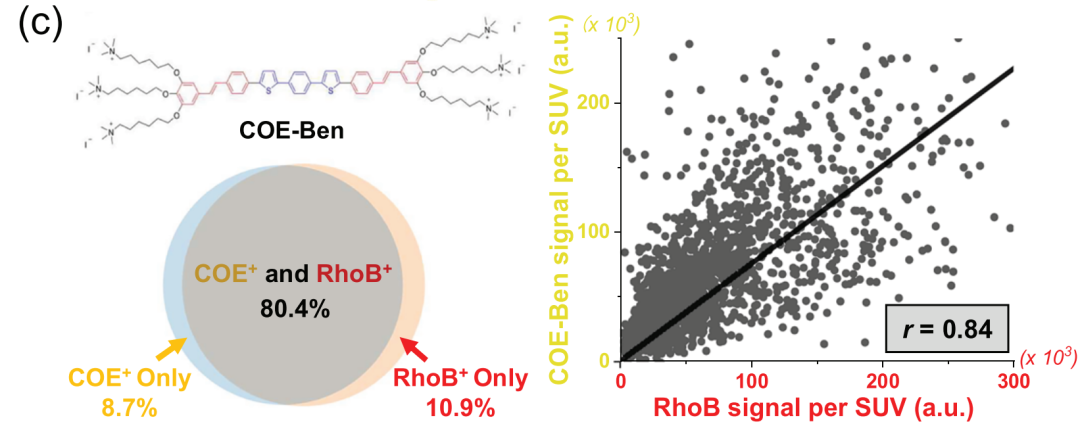
在“Direct imaging with multidimensional labelling and high-content analysis allows quantitative categorization and characterizations of individual small extracellular vesicles and nanoparticles (sEVPs)”这篇文章中[2],作者利用多维荧光标记和全内反射荧光显微镜技术(TIRF),结合新开发的水溶性脂质膜探针共轭寡电解质COE-Ben(Aco-490),对sEVPs进行标记和成像。通过这种技术,作者将sEVPs分为七个不同的亚群,并对每个亚群中的单个颗粒进行详细的定量特征分析,包括CD63计数、相对颗粒大小、货物浓度以及不同货物之间的相关性。结果发现sEVPs展现出显著的内在异质性,这种异质性不仅存在于不同细胞类型的sEVPs之间,也存在于同一细胞类型的sEVPs内部,不同细胞类型的sEVPs在亚群分布上存在显著差异。COE-Ben在SUV上实现了约90%的标记,显著优于PKH26和CellVue® Claret(<3%),同时可以有效染色脂质双层膜,但无需像传统膜染料那样进行有机相制备,它的水溶性特性能够防止聚集,这使得数据更加纯净、准确,同时降低了假阳性的风险。COE-Ben能够有效区分囊泡状和非囊泡状的颗粒,包括脂蛋白,从而更深入地揭示了sEVPs在细胞异质性方面的特性。这项研究不仅揭示了sEVPs的显著异质性,还展示了不同细胞类型sEVPs的独特亚群分布,为基于sEVP的治疗诊断应用提供了新的工具和见解。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同类型的水溶性染料COE-Ben(Aco-490)标记纳米颗粒(sEVPs)。
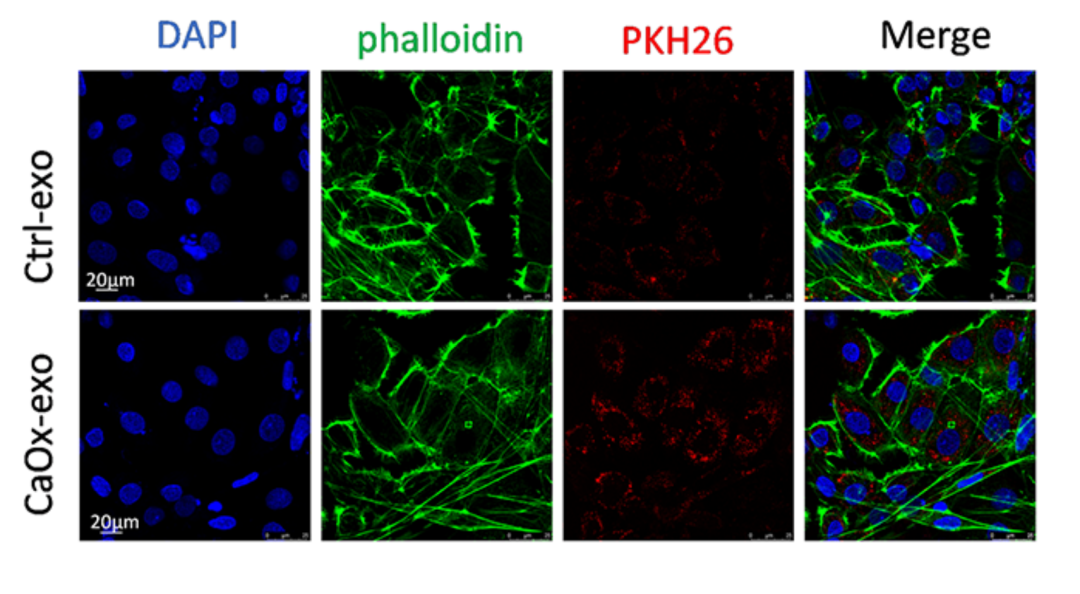
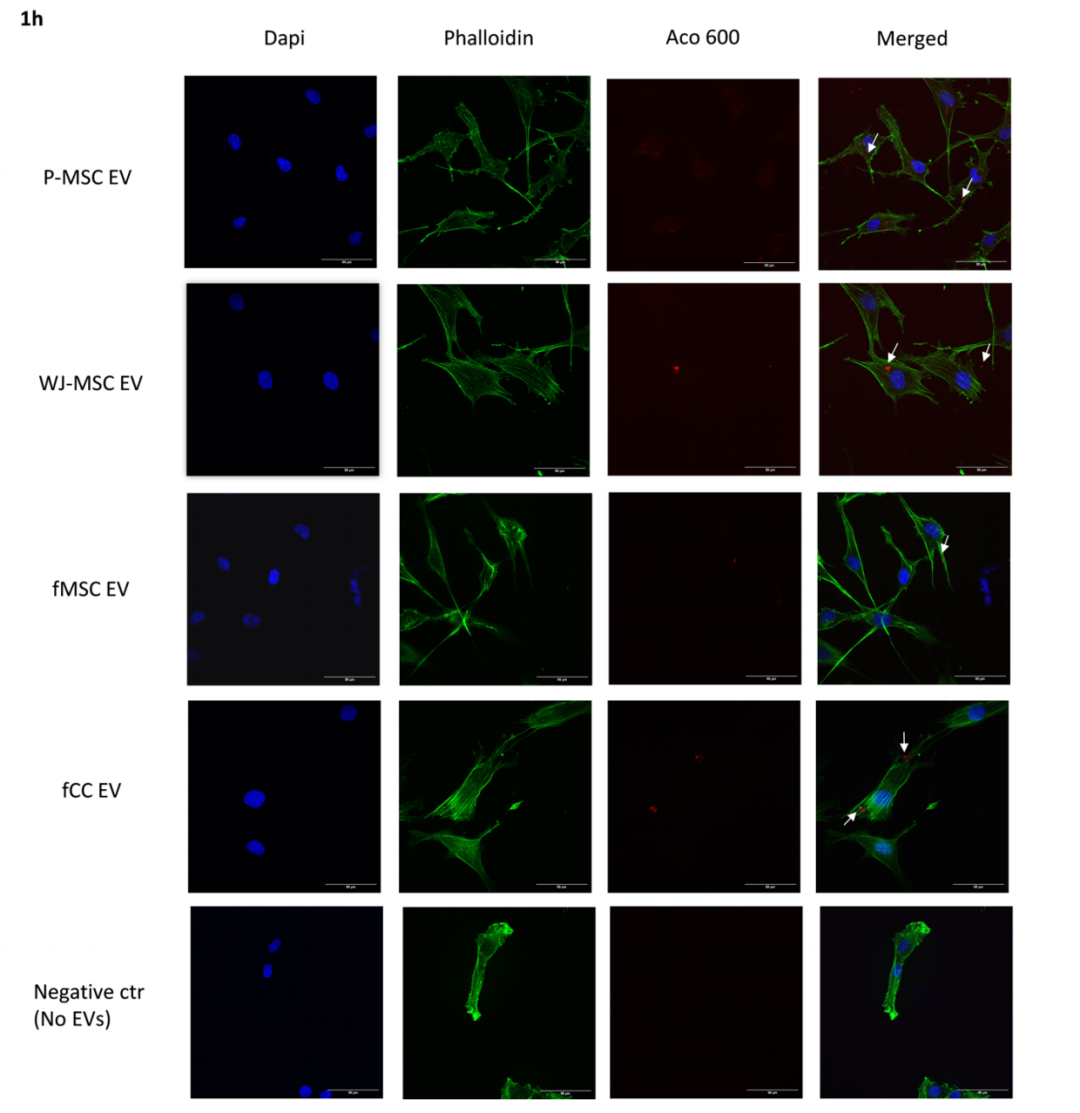
在“Ontogenetic stage and type of donor cells shape extracellular vesicles’ therapeutic potential for Osteoarthritis”这篇文章中[3],作者研究了四种不同来源的EVs,包括两种来自绵羊胎儿的原代细胞(关节软骨细胞fCCs和脐带血fMSCs),以及两种来自人类围产期的永生化细胞系(围产期WJ-MSCs和羊膜P-MSCs),在骨关节炎(OA)模型中炎症诱导的成年绵羊软骨细胞和滑膜细胞治疗效果。结果发现供体细胞的发育阶段对EVs的治疗潜力有显著影响,胎儿来源的EVs在抗炎、促进软骨基质重塑及细胞摄取效率上均显著优于围产期来源的EVs,且胎儿软骨细胞EVs对软骨细胞疗效最佳,胎儿间充质干细胞EVs对滑膜细胞疗效最优。由于胎儿软骨细胞来源的EVs和胎儿MSCs来源的EVs分别对软骨细胞和滑膜细胞具有特异性治疗作用,所以联合应用这两种EVs可能为OA治疗提供更全面的治疗效果。这项研究强调了在选择EVs供体细胞时,供体的发育阶段可能比细胞类型本身更为关键,并为开发更有效的OA治疗策略提供了新的思路。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同款的Aco-600标记四种不同细胞来源的EVs,与发炎的成年绵羊软骨细胞共孵育后用激光共聚焦显微镜观察。
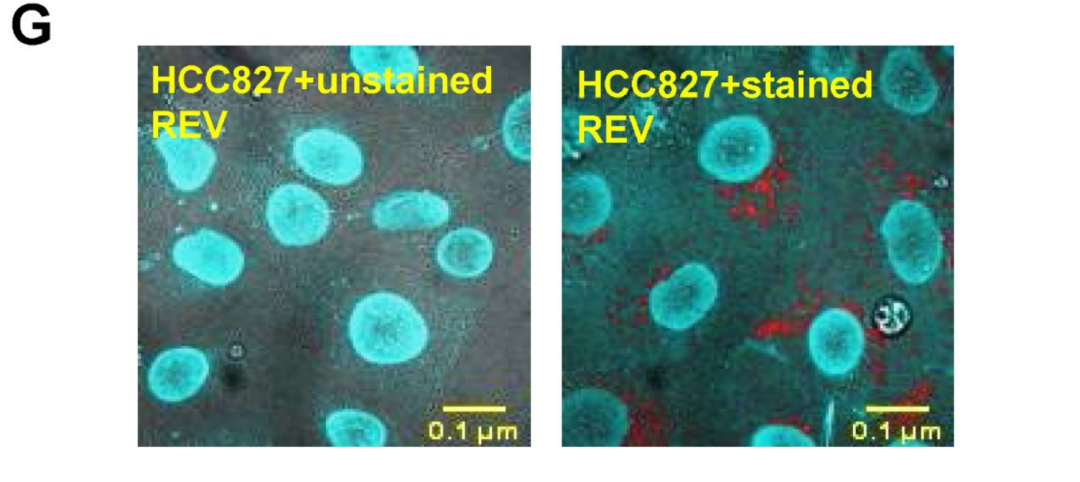
在“Tumor-derived extracellular vesicles convey solute transporters to induce bioenergetic dependence shift contributing to treatment resistance”这篇文章中[4],作者发现酪氨酸激酶抑制剂(TKI)耐药的肿瘤细胞通过释放细胞外囊泡(EVs),将代谢转运蛋白(谷氨酰胺转运蛋白SLC1A5)传递给TKI敏感细胞,诱导其发生代谢重编程和STAT3信号激活,从而获得耐药性;此外,这些EVs还能重塑肿瘤微环境,促进成纤维细胞、上皮细胞和巨噬细胞向促肿瘤表型转化。这项研究揭示了SLC1A5可作为TKI耐药的潜在生物标志物和治疗靶点,为克服肿瘤靶向治疗耐药提供了新策略。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同款的Aco-600标记TKI耐药细胞来源的EVs,与HCC827受体细胞共孵育后用激光共聚焦显微镜观察。
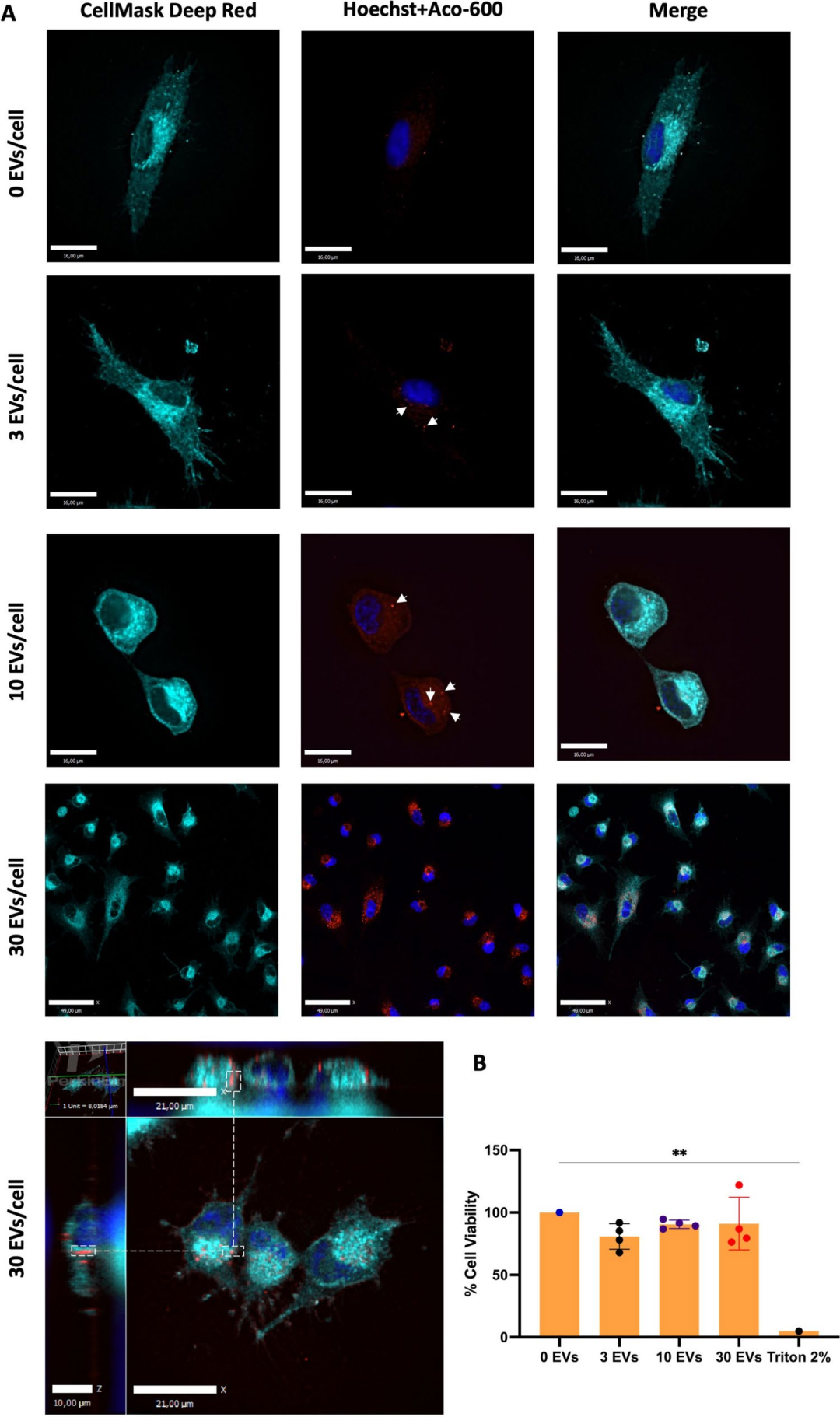
在“Targeting Cytokines: Evaluating the Potential of Mesenchymal Stem Cell Derived Extracellular Vesicles in the Management of COVID-19”这篇文章[5]主要探讨了从人类脂肪组织中提取的间充质干细胞(MSCs)来源的细胞外囊泡(EVs)在管理COVID-19中的潜力。作者从4位健康女性供体的脂肪组织中分离出MSCs,并从这些细胞中获取EVs(ASC-EVs)。并进行了鉴定,纯化,摄取,抗病毒和抗炎活性测试。结果发现,ASC-EVs在低浓度下能够显著减少感染SARS-CoV-2的肺泡细胞释放的促炎细胞因子(如IL-6、IL-8和MCP-1),且不会触发炎症介质或影响细胞活性。尽管只有在高浓度下,ASC-EVs才显示出对病毒复制的显著抑制作用,但其抗炎效果表明,ASC-EVs可以通过减少炎症反应来改善COVID-19症状,且具有治疗应用的安全性,为未来治疗COVID-19提供了新的潜在策略。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同款的Aco-600标记脂肪组织来源的EVs(ASC-EVs),与A549-hACE2细胞共孵育后用激光共聚焦显微镜观察。
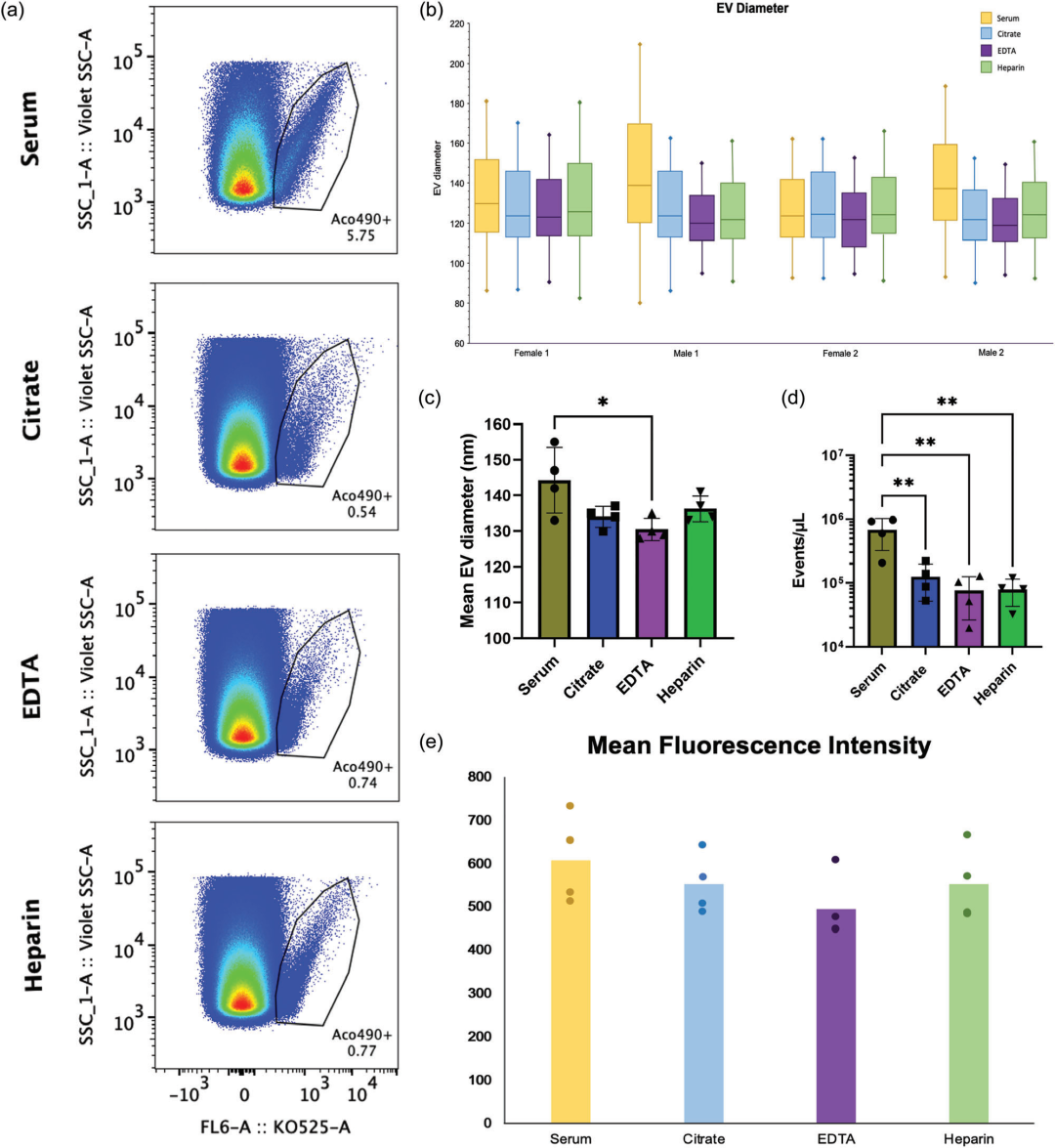
在“Choice of blood collection methods influences extracellular vesicles counts and miRNA profiling”这篇文章中[6],作者发现从不同抗凝剂(柠檬酸盐、肝素、EDTA)和血清容器收集的等量血浆中分离出的细胞外囊泡(EVs)在数量、大小和抗原组成上存在显著差异。血清样本中EVs的数量最多且大小范围最广,而EDTA抗凝管中的miRNA表达水平普遍最高。尽管不同抗凝剂对EVs的抗原组成影响较小,但采集方法的选择显著影响了EVs和miRNA的检测结果。结果表明,血液采集方法的选择对于基于EVs和miRNA的疾病标志物研究和临床应用至关重要。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同类型的Aco-490标记血浆来源的EVs,纳米流式细胞术图谱表明Aco-490染料是一种荧光性的膜特异性探针,在插入脂质双层时发出荧光,这种机制最大限度地减少了常见EV污染物的干扰。
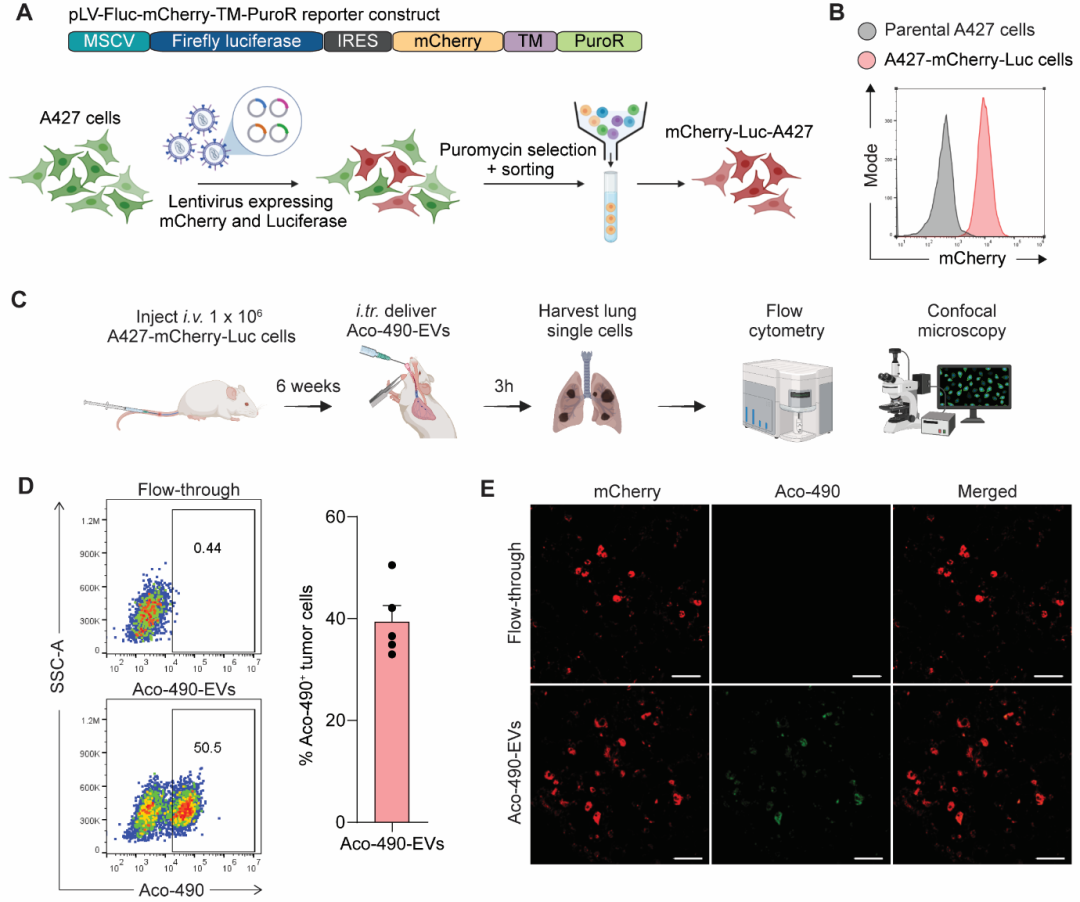
在“Combination of KRAS ASO and RIG-I agonist in extracellular vesicles transforms the tumor microenvironment towards effective treatment of KRAS-dependent cancers”这篇文章中[7],作者利用红细胞衍生的EVs(RBCEVs)作为载体,成功地将KRAS ASO和RIG-I激动剂免疫调节RNA(immRNA)递送至KRAS突变的肿瘤细胞中,并评估了这种联合治疗在结直肠癌和非小细胞肺癌(NSCLC)肿瘤模型以及患者来源的胰腺癌类器官中的治疗效果,还分析了肿瘤微环境的变化、树突状细胞的激活和T细胞记忆的形成。结果发现EV介导的ASO和immRNA递送能够有效抑制KRAS突变,并激活RIG-I,从而引发强大的抗肿瘤免疫反应。KRAS ASO和immRNA的联合治疗在KRAS突变的癌细胞中显著增强了RIG-I信号通路的激活,诱导了肿瘤细胞的免疫原性死亡,并在体外和体内模型中显示出强大的抗肿瘤效果。这项研究提供了一种新的治疗KRAS突变癌症的方法,这种联合治疗策略通过靶向KRAS突变并激活免疫系统来增强抗肿瘤效果,这种方法的创新之处在于它能够同时解决肿瘤细胞内在的KRAS驱动的增殖和免疫微环境的免疫抑制问题,为KRAS突变癌症的治疗提供了新的希望,具有潜在的临床转化价值。该研究中使用了与本公司水溶性外泌体荧光标记染料Aco-600(UR52423)同类型的Aco-490标记红细胞来源的EVs(RBCEVs),与A427肺癌细胞共孵育后用激光共聚焦显微镜观察。
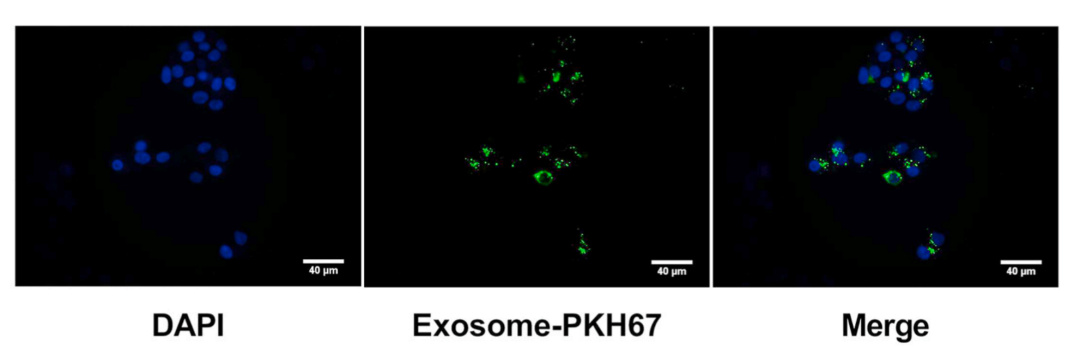
水溶性共轭寡电解质(COEs)不仅可以应用于细胞外囊泡的标记,例如非小细胞肺癌个性化治疗[8],动脉粥样硬化[9],人牙周韧带细胞的成骨分化[10];也可以用于体内肿瘤追踪[11],还可以细菌革兰氏染色分型[12]。细胞摄取实验是常见的外泌体细胞实验,用来验证外泌体被细胞摄取的情况。我们专门针对水溶性外泌体荧光标记染料Aco-600做了细胞摄取及共孵育实验,外泌体与MCF细胞共孵育24h后的激光共聚焦拍摄结果如下图所示,结果证明Aco600游离染料使用100KD的超滤管通过置换的方式可去除干净,Aco-600可标记外泌体,并能稳定用于激光共聚焦拍摄,外泌体与细胞共孵育24h后可被靶细胞摄取,荧光信号较强。

参考文献:
[1] Water-soluble extracellular vesicle probes based on conjugated oligoelectrolytes. Science Advances. 2023 Jan 13;9(2):eade2996.
[2] Direct imaging with multidimensional labelling and high-content analysis allows quantitative categorization and characterizations of individual small extracellular vesicles and nanoparticles (sEVPs). Journal of Extracellular Vesicles. 2024 Dec;13(12):e12520.
[3] Ontogenetic stage and type of donor cells shape extracellular vesicles’ therapeutic potential for Osteoarthritis. Stem Cell Research & Therapy.2025 Sep 1;16(1):478.
[4] Tumor-derived extracellular vesicles convey solute transporters to induce bioenergetic dependence shift contributing to treatment resistance.Theranostics. 2024 Sep 30;14(16):6350-6369.
[5] Targeting Cytokines: Evaluating the Potential of Mesenchymal Stem Cell Derived Extracellular Vesicles in the Management of COVID-19. Stem Cell Reviews And Reports. 2025 Feb;21(2):564-580.
[6] Choice of blood collection methods influences extracellular vesicles counts and miRNA profiling. Journal of Extracellular Biology. 2024 Oct 22;3(10):e70008.
[7] Combination of KRAS ASO and RIG-I agonist in extracellular vesicles transforms the tumor microenvironment towards effective treatment of KRAS-dependent cancers. Theranostics. 2025 Jun 9;15(14):6818-6838.
[8] Customised design of antisense oligonucleotides targeting EGFR driver mutants for personalised treatment of non-small cell lung cancer.Ebiomedicine. 2024 Oct:108:105356.
[9] Endocytosis of red blood cell extracellular vesicles by macrophages leads to cytoplasmic heme release and prevents foam cell formation in atherosclerosis. Journal of Extracellular Vesicles. 2023 Aug;12(8):e12354.
[10] Enhanced osteogenic differentiation of human periodontal ligament cells by mature osteoclasts. Journal of Oral Biosciences. 2025 Jun;67(2):100632.
[11] Conjugated Oligoelectrolytes for Long-Term Tumor Tracking with Incremental NIR-II Emission. Advanced Materials. 2022 May;34(20):e2201989.
[12] Gram-Typing Using Conjugated Oligoelectrolytes. Advanced Functional Materials. 2020 Aug;30(42):2004068.
相关链接:
水溶性外泌体荧光标记染料(Aco-600,红色)
外泌体红色荧光标记染料(PKH26)
外泌体绿色荧光标记染料(PKH67)
扫码关注更多
